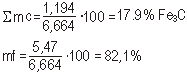Univerzitet
u Zenici
Mašinski fakultet
Katedra za proizvodne tehnologije i mašine
Materijali
Univerzitet
u Zenici
|
Pravilo faza
materijal pripremio student: Osmančević Edin
mentor: doc.dr. Nađija Haračić
PRAVILO FAZA
Konstrukcija faznih dijagrama je u velikoj mjeri olakšana pomoću nekih pravila, koja proizilaze iz termodinamike. Među njima je svakako najvažnije Gibbs-ovo pravilo faza koje kaže: maksimalan broj faza F, koje lako koegzistiraju u nekom sistemu, plus broj stepena slobode P, jednak je sumi komponenata sistema K + 2;
F + P = K + 2 => P = K - F + 2
Definicije pojedinačnih članova gornje jednadžbe su sljedeće:
Faza - F je homogeni dio sistema, koji je od drugih djelova sistema odvojen graničnim površinama i ima iste fizikalne i hemijske osobine u svakom svom dijelu.
Broj stepena slobode - P su oni uslovi (temperatura, pritisak, sastav) na koje lahko utičemo iz vana i koji se lahko mijenjaju neovisno jedan od drugog. Te uslove možemo tačno odrediti, da bi stanje sistema u ravnoteži bilo tačno definisano.
Komponente - K najmanji broj supstanci koje grade sistem. U metalnim sistemima se taj broj obično poklapa sa brojem elemenata.
Pravilo faza predpostavlja, da su temperatura, pritisak i koncentracija jedine promjenljive, koje lahko utiču na odnose faza i na njih lahko utičemo izvana. Ako bi se pokazalo,da treba uzeti u obzir i neku drugu promjenljivu, npr. površinski napon, morali bi konstantu u faznom pravilu povećati sa 2 na 3. Ako proučavamo odnose u faznom dijagramu pri konstantnom pritisku, npr. pri konstantnom atmosferskom pritisku kao što je to običaj, vladaju opet drugi uslovi: Pošto je stim jedan stepen slobode iscrpljen, moramo konstantu u gornjoj jednadžbi smanjiti sa 2 na 1:
F + P = K + 1 => P = K - F + 1
Ponekad je očiglednije pravilo faza izraziti za primjer, kada je broj stepena slobode jednak nuli. Taj primjer nastupa onda, kada su temperatura i sastav faza u ravnoteži nedvosmisleno određeni. U tom slučaju je broj faza je najveći:
Fmax = K + 1
i imamo slučaj takozvane nonvarijantne ravnoteže. Ako je broj faza za 1 manji od Fmax, ravnoteža je jednovarijantna (univarijantna). Ako je broj faza za 2 manji od Fmax, imamo divariantnu ravnotežu. O obliku,veličini, količini i rasporedu neke faze Gibbsov zakon nam naravno ne daje ništa određeno. Za to je potrebna mikroskopska ili rendgenska analiza.
ZAKON POLUGE
U svakoj tački na dijagramu stanja se mogu odrediti broj i vrste faza, te njihov sastav i količina. Pri tome se koristi pravilo poluge ili konode; sastav tečne faze se nalazi uvijek na liniji likvidusa, a čvrste faze na liniji solidusa.
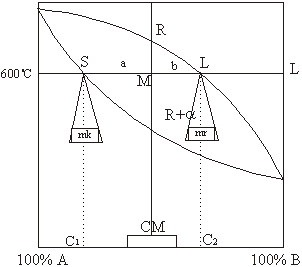
Sl.1. Objašnjenje zakona poluge
Neka legura čija se tačka stanja (CM,T) nalazi u dvofaznoj oblasti, sastoji se iz dvije faze različitog sastava, pri čemu je odnos količina obe faze dat položajem tačke stanja u odnosu na granične linije. Posmatrajmo leguru sa 60% A ili 40% B zagrijanu na 600 oC. Tačka stanja M unesena je u dijagram na (sl. 1.) Legura se na toj temperaturi, prema dijagramu stanja sastoji od kristala a, sastava S, (bogatih komponentom A) i rastopa sastava L, bogatog komponentom B.
Sastave kristala a i rastopa L, dobijamo na isti način. Kroz tačku M pri 60 % A i 600 oC povuče se horizontalna linija. Ona presijeca solidus krivu u tački S, a likvidus u tački L koje određuju koncentracioni sastav kristala i rastopa na toj temperturi. (C1 i C2).
Horizontalne tj izotermalne linije koje se prostiru od jedne do druge granične linije nekog dvofaznog polja nazivamo linije povezivanja ili konode. One pokazuju koje su faze pri određenoj temperaturi međusobno u ravnoteži. Pored toga, moguće je pomoću linija povezivanja lahko izračunati količinske udjele faza koje stoje međusobno u ravnoteži.
Napomena:
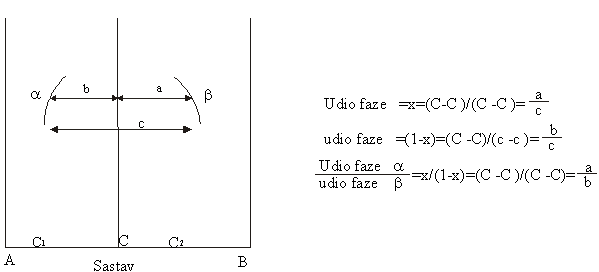
Relativna količina neke faze je proporcionalna dužini linije povezivanja (konode) na protivnoj strani od tačke legure na toj istoj liniji, tj odnos količine faze obrnuto je proporcionalan odnosu odsječaka na liniji povezivanja.
Prema analogiji sa zakonom poluge:
| Krak opterećenja x opterećenje = krak sile x sila |
Primjeri izračunavanje težinskog udjela mikrokonstituenata u čeliku
1) Podeutektoidni čelik sa 0,16% ugljika
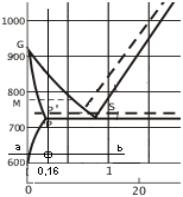
krak a = krak perlita
krak b = krak ferita
a = 0,16 - 0,006 = 0,154%
b = 0,765 - 0,16 = 0,605%
a + b = 0,759%
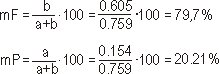
2.1. Nadeutektoidni čelik sa 1,2% ugljika
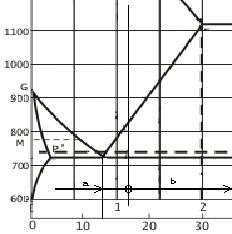
krak a= krak Fe3C
krak b= krak perlita
a = 1,20 - 0,765 = 0,435%
b = 6,67 - 1,20 = 5,470%
a + b = 0,435+ 5,470 = 5,905%
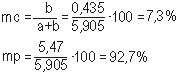
2.2. Izračunavanje faza ferita i cementita
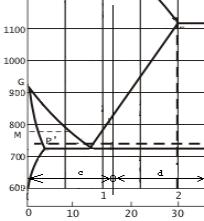
Krak c = krak cementita
Krak d = krak ferita
c = 1,20 - 0,006 = 1,194
d = 6,67 - 1,20 = 5,47
c + d = 1,194 + 5,47 = 6,664